这是2022年我创建的第一个Wikipedia条目~~~
虽然只是一个简单的试剂介绍而已……
尿素-过氧化氢加合物(也可称为过氧化氢-尿素加合物或UHP )是由等当量的过氧化氢和尿素加合形成的固体。该化合物是一种白色晶体,溶于水后可以产生游离的过氧化氢。尿素-过氧化氢加合物在常温下为固体,且不含无水,在作氧化剂时比液态双氧水的稳定性和可靠性更高。在牙科领域,尿素-过氧化氢加合物也可称作过氧化脲,它可以当作过氧化氢的来源来使用,可应用于漂白、消毒和氧化等方面。
| 识别 | |
|---|---|
| 别名 | Hyperol, artizone, 过氧化氢-尿素加合物, UHP |
| CAS号 | 124-43-6 |
| PubChem | 31294 |
| ChemSpider | 29034 |
| SMILES | O=C(N)N.OO |
| ChEBI | 75178 |
| 性质1 | |
|---|---|
| 化学式 | CH6N2O3 |
| 摩尔质量 | 94.07 g·mol-1 |
| 外观 | 白色固体 |
| 密度 | 1.50 g/cm3 |
| 熔点 | 75-91.5 °C (分解) |
| GHS提示词 | 危险 |
制备
在低于60℃的温度下将尿素溶解在30%的过氧化氢溶液中(摩尔比为2:3)。冷却该溶液时,尿素-过氧化氢加合物即以沉淀形式析出 2
用高锰酸钾滴定尿素-过氧化氢加合物中的过氧化氢时,测得的含量为35.4%,相当于理论最大值的97.8%。过氧化氢有效含量偏低的原因是按这种方法制备的尿素-过氧化氢加合物中会含有少量的尿素杂质。
与结晶水相似,过氧化氢与尿素以 1:1的计量比共结晶。工业上通过将尿素溶解在过量的浓过氧化氢溶液中再结晶来生产尿素-过氧化氢加合物(年产量在百吨量级)。实验室的制备方法也与之类似。 3
结构和性质
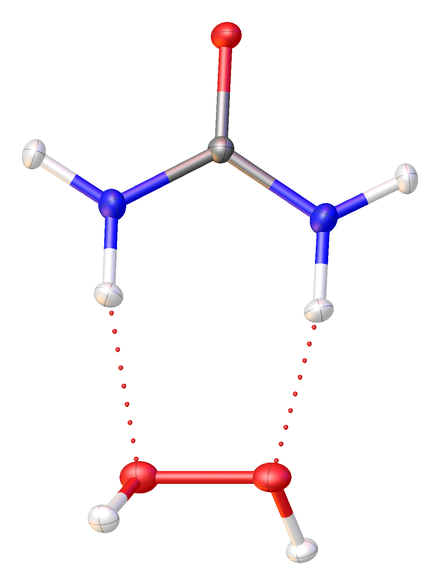
该加合物的固态结构已通过中子衍射确定。 4
过氧化氢-尿素加合物是一种易溶于水,无味的晶体,通常为白色粉末、无色针状或片状固体。 2当尿素-过氧化氢加合物溶解后会分解成尿素和过氧化氢。因此,尿素-过氧化氢加合物是一种与过氧化氢性质相似的氧化剂。然而,室温下,尿素-过氧化氢加合物可以在催化剂存在下以可控的速率释放过氧化氢,因此,该化合物适合作为过氧化氢的安全替代品。尿素-过氧化氢加合物在高于 82 °C时会加速分解 5,因此在使用尿素-过氧化氢加合物时,不应将其加热到 60 °C以上(尤其是纯净的尿素-过氧化氢加合物)。
商业尿素-过氧化氢加合物样品的溶解度从 0.05 g/mL 6到超过 0.6 g/mL 不等。 7
应用
消毒剂和漂白剂
尿素-过氧化氢加合物常用作化妆品和药品中的消毒漂白剂。 这种化合物还可用于制备牙齿美白制剂。 8 它还可以用于缓解牙龈、口腔黏膜表面和嘴唇的轻微炎症,包括口腔溃疡和牙齿刺激,并且还可以乳化、分散耳垢。 9
尿素-过氧化氢加合物也用作隐形眼镜的消毒剂,或在漱口水、滴耳剂或表面伤口和溃疡的消毒剂中作消毒的有效成分。
有机合成试剂
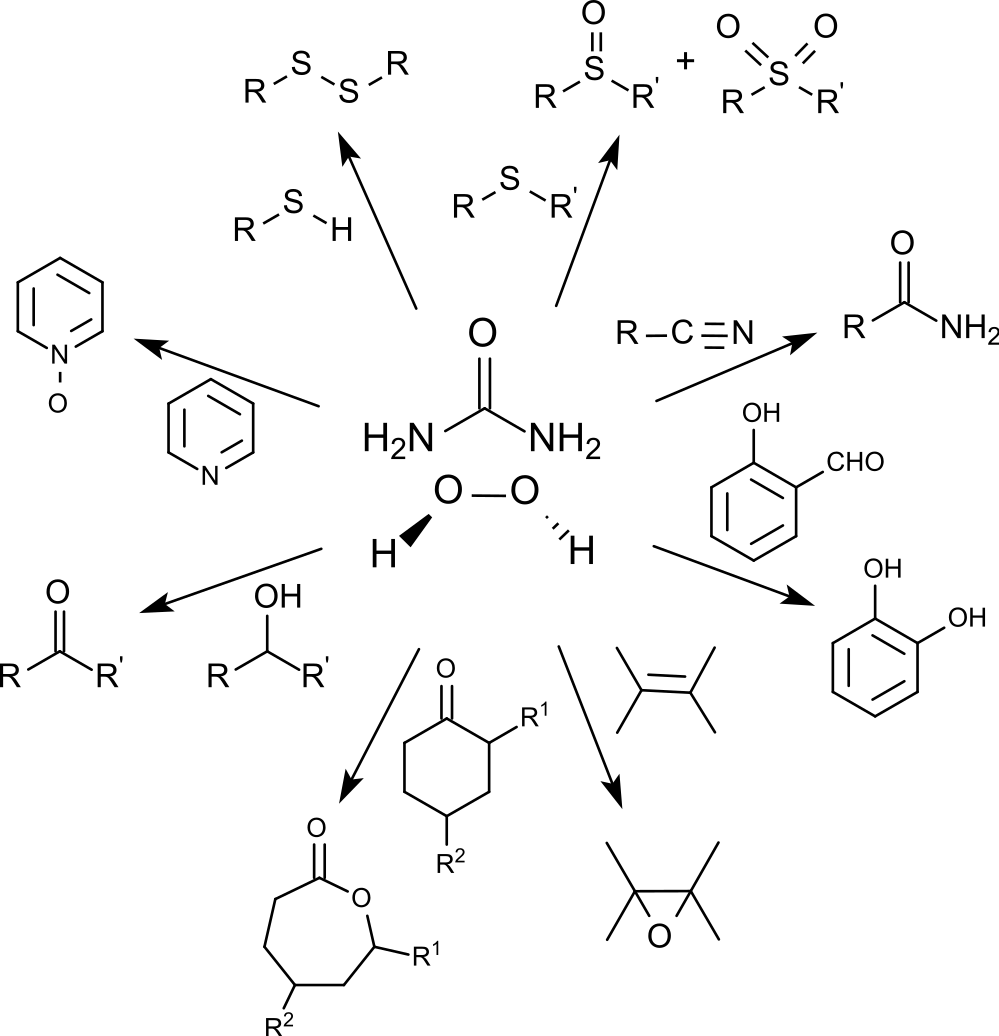
在实验室中,尿素-过氧化氢加合物可用替代过氧化氢使用,由于它更容易处理,因此在实验室应用中较过氧化氢方便。 3 10 11尿素-过氧化氢加合物的反应性可以通过选择合适的反应条件控制,它是一种稳定、易于处理的有效氧化剂。尿素-过氧化氢加合物可以以环保的方式提供氧化产物,并且通常产率较高,尤其是在存在有机催化剂(如顺丁烯二酸酐12 或无机催化剂(如钨酸钠)的情况下,使用尿素-过氧化氢加合物进行氧化可以高产率地得到氧化产物。 13
尿素-过氧化氢加合物可选择性氧化硫醇产生二硫键, 12还可以将仲醇转化为酮, 13硫化物转化为亚砜和砜, 14腈转化为酰胺, 14 N-杂环转化为氧化胺。 14 15
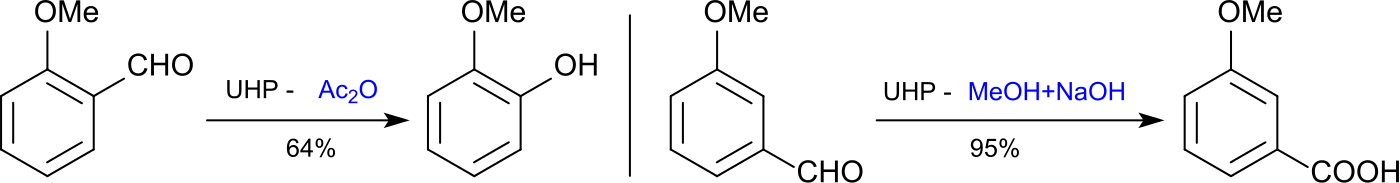
尿素-过氧化氢加合物可以将羟基苯甲醛转化为苯二酚( Dakin 反应) 14 16 也可以在合适的条件下得到相应的苯甲酸衍生物。 16
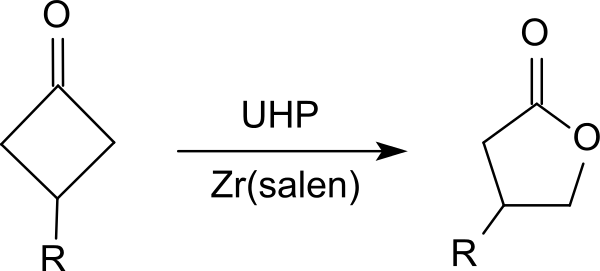
尿素-过氧化氢加合物可将酮氧化为酯(特别是环酮),例如氧化环己酮17、环丁酮的衍生物18产生内酯( Baeyer-Villiger 氧化)。
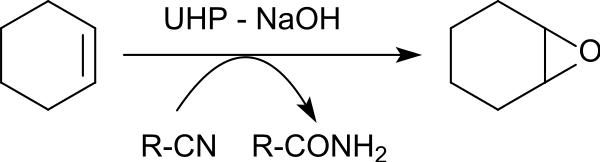
在苯甲腈存在下,尿素-过氧化氢加合物可以对各种烯烃环氧化,产生环氧乙烷,产率为 79% 至 96%。 19
转移到烯烃上的氧原子来自苄腈中间形成的过氧亚胺酸。过氧亚胺酸被还原后所得的亚胺酸互变异构为苯甲酰胺。
安全
该化合物是强氧化剂,可能引起皮肤刺激和严重的眼部损伤。
参见
本文采用CC-BY-SA-4.0协议发布,来自我创建的Wikipedia条目尿素-过氧化氢加合物,由于个人水平限制,本条目难免会有知识谬误以及描述不清等情况,欢迎读者在维基条目中编辑修改或对本网站在GitHub上的源代码提供Pull request,也欢迎在评论区多多指教。
参考文献及注释
-
若非注明,所有数据均出自一般条件(25 ℃,100 kPa)下。 ↩
-
C.-S. Lu, E.W. Hughes, P.A. Giguère, The crystal structure of the urea-hydrogen peroxide addition compound CO(NH2)2 H2O2, J. Am. Chem. Soc., 1941, 63 (6): 1507–1513, doi:10.1021/ja01851a007 ↩ ↩2
-
Yu, Lei; Meng, Bo; Huang, Xian. Urea-Hydrogen Peroxide Complex: A Selective Oxidant in the Synthesis of 2-Phenylselenyl-1,3-butadienes. Synthetic Communications. 2008, 38 (18): 3142. doi:10.1080/00397910802109224. ↩ ↩2
-
Fritchie, Jr., C. J.; McMullan, R. K. Neutron Diffraction Study of the 1:1 Urea:Hydrogen Peroxide complex at 81 K. Acta Crystallographica Section B. 1981, 37 (5): 1086. doi:10.1107/S0567740881005116. ↩
-
H. Heaney, F. Cardona, A. Goti, A.L. Frederick. Encyclopedia of Reagents for Organic Synthesis. 2013. ISBN 978-0471936237. doi:10.1002/047084289X.rh047.pub3. ↩
-
Sigma-Aldrich specification sheet ↩
-
Chemicalland data sheet ↩
-
Mokhlis, G. R.; Matis, B. A.; Cochran, M. A.; Eckert, G. J. A Clinical Evaluation of Carbamide Peroxide and Hydrogen Peroxide Whitening Agents during Daytime Use. Journal of the American Dental Association. 2000, 131 (9): 1269–77. PMID 10986827. doi:10.14219/jada.archive.2000.0380. (原始内容存档于2013-02-23). ↩
-
Ear Drops GENERIC NAME(S): CARBAMIDE PEROXIDE. WebMD. [July 3, 2021]. ↩
-
Varma, Rajender S.; Naicker, Kannan P. The Urea−Hydrogen Peroxide Complex: Solid-State Oxidative Protocols for Hydroxylated Aldehydes and Ketones (Dakin Reaction), Nitriles, Sulfides, and Nitrogen Heterocycles. Organic Letters. 1999, 1 (2): 189. doi:10.1021/ol990522n. ↩
-
Harry Heaney, Francesca Cardona, Andrea Goti, “Hydrogen Peroxide–Urea” Encyclopedia of Reagents for Organic Synthesis 2008. doi:10.1002/047084289X.rh047.pub2 ↩
-
B. Karami, M. Montazerozohori, M. H. Habibi, Urea-Hydrogen Peroxide (UHP) oxidation of thiols to the corresponding disulfides promoted by maleic anhydride as mediator (PDF), Molecules, 2005, 10 (10): 1358–1363, PMC 6147623 可免费查阅, PMID 18007530, doi:10.3390/10101385 (German) ↩ ↩2
-
J. Pielichowski. Microwave-assisted oxidation of alcohols using urea hydrogen peroxide. [2016-05-10] (English). ↩ ↩2
-
R.S. Varma, K.P. Naicker, The Urea-Hydrogen Peroxide Complex: Solid-State Oxidative Protocols for Hydroxylated Aldehydes and Ketones (Dakin Reaction), Nitriles, Sulfides, and Nitrogen Heterocycles, Org. Lett.: 189–191, doi:10.1021/ol990522n (German) ↩ ↩2 ↩3 ↩4
-
D. Rong, V.A. Phillips, R.S. Rubio, M.A. Castro, R.T. Wheelhouse, A safe, convenient and efficient method for the preparation of heterocyclic N-oxides using urea-hydrogen peroxide, Tetrahedron Lett.: 6933–6935, doi:10.1016/j.tetlet.2008.09.124 (German) ↩
-
H. Heaney, A.J. Newbold, The oxidation of aromatic aldehydes by magnesium monoperoxyphthalate and urea-hydrogen peroxide, Tetrahedron Lett., 2001, 42 (37): 6607–6609, doi:10.1016/S0040-4039(01)01332-6 (German) ↩ ↩2
-
M.Y. Rios, E. Salazar, H.F. Olivo, Baeyer–Villiger oxidation of substituted cyclohexanones via lipase-mediated perhydrolysis utilizing urea–hydrogen peroxide in ethyl acetate, Green Chem., 2007, 9 (5): 459–462, doi:10.1039/B618175A (German) ↩
-
A. Watanabe, T. Uchida, K. Ito, T. Katsuki, Highly enantioselective Baeyer-Villiger oxidation using Zr(salen) complex as catalyst, Tetrahedron Lett., 2002, 43 (25): 4481–4485, doi:10.1016/S0040-4039(02)00831-6 (German) ↩
-
L. Ji, Y.-N. Wang, C. Qian, X.-Z. Chen, Nitrile-promoted alkene epoxidation with urea-hydrogen peroxide (UHP), Synth. Commun., 2013, 43 (16): 2256–2264, doi:10.1080/00397911.2012.699578 (German) ↩