科廷–哈米特定律
科廷–哈米特定律(Curtin–Hammett principle),是由大卫·亚罗·科廷和路易斯·普朗克·哈米特提出的化学动力学上的一个定律。该定律表明,对于一个反应而言,若其反应中间体或反应物具有一对迅速转换的异构体(通常情况下为构象异构),则由异构体产生的不可逆产物(即不能通过平衡移动反应变回该异构体)的比例将同时取决于过渡态转变为产物的自由能以及这两种异构体之间转换所需要的能量差。结果使得产物之间的比例并不仅仅由中间体或反应物的异构体平衡时的比例所决定。 1 2科廷–哈米特定律已经被用于解释大量的具有立体选择性的反应。
定义
科廷–哈米特定律适用于由两种达成平衡转换的底物所产生的两种产物的系统。这些快速转化的底物可以是对映体、非对映体或者结构异构。产物的产生必须是不可逆的,并且这两种产物之间也不能相互转化。3 举例说明:假设化学物种A和B之间可以相互转化,同时A可以不可逆的生成C,而B可以不可逆的生成D。
K是A和B异构化平衡的平衡常数,k1和k2则是A和B各自生成C和D的速率常数。当平衡转化的速率远大于k1和k2时,那么由科廷–哈米特定律可以得知,C、D两种产物的比例是不由A和B平衡时的比例决定的,而是由各自的过渡态的能量所决定的。如果反应物A和B所具有的能量不同(意即A和B相互转化时会产生能量变化),那么产物的比例仅仅由各自的过渡态和相对应的产物之间的能量差所决定。不过在真实的反应历程中,这两种反应物常常有着相同的能量级别,尽管它们相互转化时跨过的能垒会低到使科廷–哈米特定律起作用。在这种情况下,产物的比例就由A和B的比例以及其各自生成产物C和D所跨过的能垒决定。 反应能线图如下:
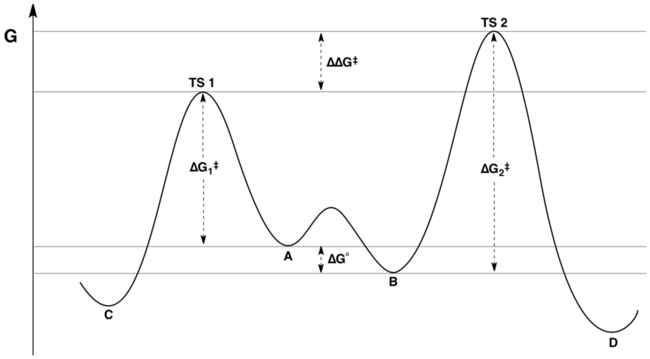
产物的比例取决于图中的标记值 ΔΔG‡ : C 将会是主要产物, 因为过渡态1(TS1)的能量比过渡态2(TS2)的能量低。通常认为的产物比例并不反映物质A和B的相对自由能的说法是不正确的。3 4 下面将给出一个引论, 产物的比例将可以被表述成 K, k1,和 k2的一个函数。
引论
一个符合科廷–哈米特定律的化学动力学反应可以被以下参数表示:
由A生成C的速率方程如下:
同样,由B生成D的速率方程为:
其中 K 是AB相互转化的平衡常数. 那么它们的速率之比可以表示为:
由于平衡转化速率相对于产物生成的速率要大, 反应物的比 [B]/[A]的值是平衡常数K,其在反应全过程中始终保持不变。因此,产物的比例可以写成:
如果反应物A和B处在相同的能量级别, 即Δ G = 0, 那么产物的比例将仅仅由各自的过渡态到产物的相对能量决定:
适用于科廷–哈米特定律的几类反应
适用于科廷哈米特定律的反应可以大致分为三类:
- 更稳定的异构体反应更快
- 不稳定的异构体反应更快
- 两者反应的速率相同
第一类:更稳定的异构体反应更快
适用于科廷—哈米特定律的第一类反应是更稳定的异构体反应更快速。当主要中间体的过渡态能量比次要中间体的过渡态能量要低时就会出现这样的情况。其主要产物由主要的异构体产生,而且产物的比例并不反映异构体平衡时的比例。
例子:哌啶的氧化
一个适用于科廷—哈米特定律第一类反应的情景在哌啶的氧化中被观测到。在N-甲基哌啶的非对映异构体中,氮的构型翻转的速率要比胺被氧化的速率要大.5 在这两个构型中,甲基在平伏键位置时的能量要比在直立键位置的能量要低3.16 kcal/mol(约合13.22kJ/mol)。6 其产物比例为 95:5, 表明了更稳定的异构体产生了更多的产物7

第二类:较不稳定的异构体反应更快
适用于科廷—哈米特定律的第二类反应是较不稳定的异构体反应更快速。在这样的情况下,虽然在热力学上表现为较少反应优势的物种, 但主要产物仍然是由这些高能量的异构体转化而来。这样,一个重要的意义在于反应的产物能够从基态时以相当低的甚至难以检测到的浓度存在的异构体转化而来。3
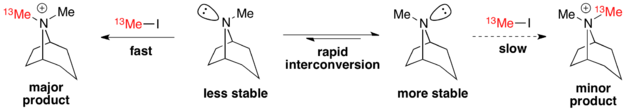
例子: 莨菪烷的N-甲基化
莨菪烷用碘甲烷进行烷基化 是一个科廷–哈米特定律下,主要产物由较不稳定的异构体生成的经典例子。3 在这里,较不稳定的异构体由于反应时经过一个更稳定的过渡态,使得其产物为主要产物。8 因此,基态时的异构体分配比例并不影响产物的分配比例。
第三类:异构体转化速率相同
对于达成平衡的两个异构体,他们分别反应的过渡态能量在假定中是可能相等的。在这种情况下产物的比例将会仅仅由基态时异构体的比例决定。此时,两种异构体的反应速率将会相同。
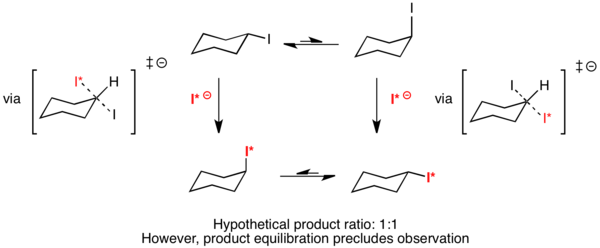
例子:碘代环己烷的 SN2 取代反应
埃利尔已经证明,对于假设的用放射性碘取代碘代环己烷的反应会有两个能量完全相同的过渡态。 9 因为不论是碘处在平伏键或者直立键的异构体,反应时都会经过一个相同的过渡态,它们的ΔΔG‡ 将完全是0。通过科廷–哈米特定律,放射性碘在平伏键的产物的比例将会是50%,同样,放射性碘在直立键的产物的比例也是50%。然而产物之间的平衡转化阻止了这一现象的观测。3
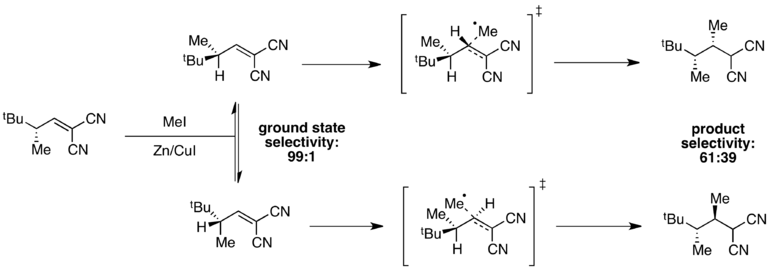
例子:甲基化反应
当基态能量不同,但过渡态能量相近时,在过渡态中某一中间体的比例将会降低,而差的整体选择性将会被观测到。比方说,在接下来的甲基化反应中观测到一个基态异构体占据高比例。
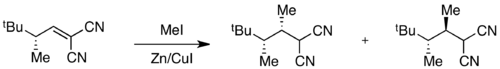
由于氢原子的1,3-烯丙位张力要小,所以该异构体在基态时比例达到99%。然而,过渡态能量同时取决于1,3-烯丙位张力的存在和甲基进攻时的空间位阻。此时,这两个因素作用的结果是相反的,过渡态的能量差要比基态的能量差要小。结果差的整体选择性就被观测到了。
本文采用CC-BY-SA-4.0协议发布,来自Wikipedia条目科廷–哈米特定律,由于个人水平限制,本条目难免会有知识谬误以及描述不清等情况,欢迎读者在维基条目中编辑修改或对本网站在GitHub上的源代码提供Pull request,也欢迎在评论区多多指教。
参考文献
-
Carey, Francis A.; Sundberg, Richard J.; (1984). Advanced Organic Chemistry Part A Structure and Mechanisms (2nd ed.). New York N.Y.: Plenum Press. ISBN 0-306-41198-9 ↩
-
IUPAC, Compendium of Chemical Terminology, 2nd ed. (the “Gold Book”) (1997). Online corrected version: (1994) Curtin-Hammett Principle ↩
-
Jeffrey I. Seeman. Effect of Conformational Change on Reactivity in Organic Chemistry. Evaluations, Application, and Extensions of Cutin–Hammett/Winstein–Holness Kinetics. Chemical Reviews. 1983, 83 (2): 83–134. doi:10.1021/cr00054a001. ↩ ↩2 ↩3 ↩4 ↩5
-
Jeffrey I. Seeman. The Curtin–Hammett Principle and the Winstein–Holness Equation. Journal of Chemical Education. 1986, 63 (1): 42–48. Bibcode:1986JChEd..63…42S. doi:10.1021/ed063p42. ↩
-
P. J. Crowley, M. J. T. Robinson and M. G. Ward. Conformational effects in compounds with 6-membered rings-XII. Tetrahedron. 1977, 33 (9): 915–925. doi:10.1016/0040-4020(77)80202-0. ↩
-
Luis Carballeira, Ignacio Pérez-Juste. Influence of calculation level and effect of methylation on axial/equatorial equilibria in piperidines. Journal of Computational Chemistry. 1998, 19 (8): 961–976. doi:10.1002/(SICI)1096-987X(199806)19:8<961::AID-JCC14>3.0.CO;2-A. ↩
-
Y. Shvo and E.D. Kaufman. Configurational and conformational analysis of cyclic amine oxides. Tetrahedron. 1972, 28 (3): 573–580. doi:10.1016/0040-4020(72)84021-3. ↩
-
Rodney D. Otzenberger, Kenneth B. Lipkowitz, Bradford P. Mundy. Quaternizations in the 8-azabicyclo[4.3.0]non-3-ene series. Journal of Organic Chemistry. 1974, 39 (3): 319–321. doi:10.1021/jo00917a008. ↩
-
Eliel, E. L. “Stereochemistry of Carbon Compounds”; McGraw–Hill: New York, 1962, pp 149–156, 234–239. ↩






